神经发育疾病(neurodevelopmental disorders,NDD)是由遗传性或获得性病因导致神经系统发育异常,造成大脑功能障碍,包括智力障碍、孤独症谱系障碍、注意力缺陷多动障碍等疾病。解析神经发育疾病的致病机制一直是神经生物学的关键课题之一,但由于伦理、人脑和非人灵长类脑组织来源的限制,即使能获得少数患者组织,也只能反映疾病的终末阶段,无法解析疾病的发生发展过程[1]。因此,对人脑发育疾病的认知和理解主要来源于对啮齿动物的研究。然后,人脑特有的复杂结构和功能分区,动物模型是无法完全再现的。干细胞技术的发展,特别是诱导多能干细胞的建立为解码神经发育疾病的发病机制提供了理想的人体细胞模型。利用带有疾病基因的患者体细胞重编程为诱导多能干细胞(induced pluripotent stem cell, iPSC)继而分化为各种类型的神经细胞的疾病模型已经广泛应用于各种神经系统疾病的研究[2]。然而神经系统疾病表型有较大异质性,既包括大脑结构的异常比如大脑的大小,又涉及到神经突触活动的问题,对于这种复杂性传统二维(2D)神经培养只能提供有限的见解。随后,通过改进2D神经培养方法开创了三维(3D)脑类器官培养方案,为神经发育疾病的研究开辟了新视野[3]。
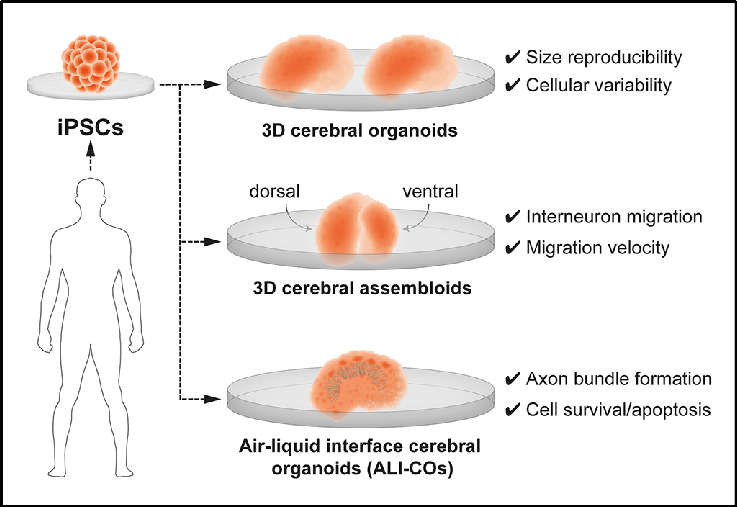
图1 体外模拟人脑发育和神经发育障碍的三维类脑器官
多能干细胞来源的脑类器官,尤其是患者特异性iPSC来源的脑类器官作为神经发育疾病的体外模型有巨大应用潜力。目前已有多个实验室利用脑类器官成功再现了胚胎早期发育中神经发育异常的相关表型(表1),其致病机制大多归因于神经祖细胞(neural progenitor cell, NPC)的细胞周期受阻、增殖和分化紊乱以及过早的神经分化和成熟等[4]。
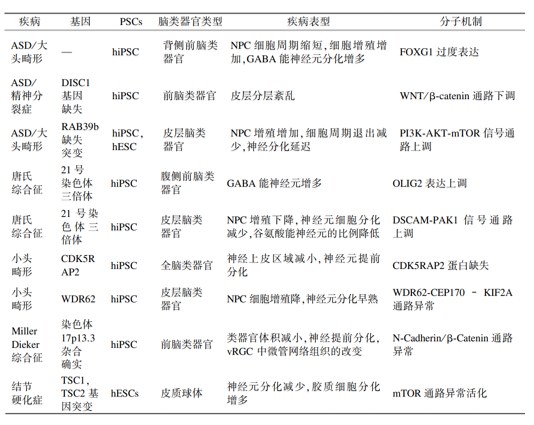
表1 3D脑类器官在神经发育疾病中的应用
利用人脑类器官模拟神经发育疾病的早期发育特征,如神经元发生、神经元迁移、大脑皮层结构和功能网络等,有效弥补了PSC来源的2D神经元研究的不足。另外,一些难以用小鼠或其他动物作为模型来研究的疾病比如小头畸形、无脑回畸形病等,借助脑类器官的研究更直接地再现了神经干细胞增殖分户的异常[5]。由此可见,大脑类器官为神经发育疾病的研究提供了一个强有力的工具。
人脑类器官具有类似于体内大脑的空间结构和细胞组成,并具有一定相应的功能特征,为解析大脑疾病开辟了新的途径。但目前人脑类器官仍有很大局限性,由PSC来源的脑类器官一般仅有5mm-1cm左右,不具备人脑的大小。由于代谢旺盛的NPC主要位于脑类器官深层,因缺少血管系统而无法得到外部的营养和氧气,类器官培养中不能长时间维持神经祖细胞的扩增,更无法实现皮质折叠凳沟回结构。此外,脑类器官还缺少免疫细胞等重要的细胞类型,也不能形成复杂神经回路。不同实验室iPSC细胞本身的异质性,脑类器官培养条件、添加的分子组合不尽相同,得到的脑类器官模型差异很大,不同批次间的脑类器官也有很大的异质性,这些都是需要注意的问题[6]。因此脑类器官的研究只是一个初始阶段,还有很长的路要走。未来将生物材料和流体系统结合设计类似血管网络的结构,将助于脑类器官的长期培养。将脑类器官移植入动物体内,生长出维持类器官持续发育的血管系统和神经连接也被证明是促进类器官成熟和存活的方法。
总之,脑类器官技术极大地促进了我们对神经发育疾病发病机制的认识,为更个体化的靶向治疗打开了一扇大门。新兴技术的不断发展将促进脑类器官技术更好地服务于神经发育疾病的研究。
参考文献
[1] Thapar A, Cooper M, Rutter M. Neurodevelopmental disorders. Lancet Psychiatry. 2017 Apr;4(4):339-346. doi: 10.1016/S2215-0366(16)30376-5. Epub 2016 Dec 13. PMID: 27979720.
[2] Sabitha KR, Shetty AK, Upadhya D. Patient-derived iPSC modeling of rare neurodevelopmental disorders: Molecular pathophysiology and prospective therapies. Neurosci Biobehav Rev. 2021 Feb;121:201-219. doi: 10.1016/j.neubiorev.2020.12.025. Epub 2020 Dec 25. PMID: 33370574; PMCID: PMC7962756.
[3] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006 Aug 25;126(4):663-76. doi: 10.1016/j.cell.2006.07.024. Epub 2006 Aug 10. PMID: 16904174.
[4] Gerrard L, Rodgers L, Cui W. Differentiation of human embryonic stem cells to neural lineages in adherent culture by blocking bone morphogenetic protein signaling. Stem Cells. 2005 Oct;23(9):1234-41. doi: 10.1634/stemcells.2005-0110. Epub 2005 Jul 7. PMID: 16002783.
[5] Mariani J, Simonini MV, Palejev D, Tomasini L, Coppola G, Szekely AM, Horvath TL, Vaccarino FM. Modeling human cortical development in vitro using induced pluripotent stem cells. Proc Natl Acad Sci U S A. 2012 Jul 31;109(31):12770-5. doi: 10.1073/pnas.1202944109. Epub 2012 Jul 3. PMID: 22761314; PMCID: PMC3411972.
[6] Lancaster MA, Knoblich JA. Generation of cerebral organoids from human pluripotent stem cells. Nat Protoc. 2014 Oct;9(10):2329-40. doi: 10.1038/nprot.2014.158. Epub 2014 Sep 4. PMID: 25188634; PMCID: PMC4160653.
成都市武侯区一环路南一段24号四川大学科技创新中心405号
yhsw33399@163.com
028-85217799
