2019年世界卫生组织发布的《世界视觉报告》指出,全球至少22亿的视力损伤患者中与角膜有关的未矫正屈光不正约有1.27亿,角膜浑浊约有420万[1]。角膜是位于眼球最前端的透明圆顶形结构,作为前屏障,角膜保护其他所有眼球结构,使其免受外部损伤。角膜也是透光和分光的结构基础,光线的透射和折射在很大程度上依赖于角膜的透明度和曲率[2],因此角膜也是视觉形成的关键组织。
干细胞治疗属于再生医学范畴,其应用于临床实践的首要目标是利用干细胞重建功能性组织。随着精准医疗概念的提出和发展,干细胞治疗也进入了新的精细阶段,针对角膜各组分的干细胞重建取得了进展。
角膜上皮重建是干细胞治疗的主战场,角膜上皮维持着角膜的无血管和相对脱水状态,使角膜透明和完整而保持清晰的视力。角膜上皮的生理来源是角膜缘干细胞(limbal stem cells,LSCs),LSC属成体干细胞,通过连续不对称地分裂、分化,并向角膜中心迁移,以补充脱落的角膜上皮细胞[3]。
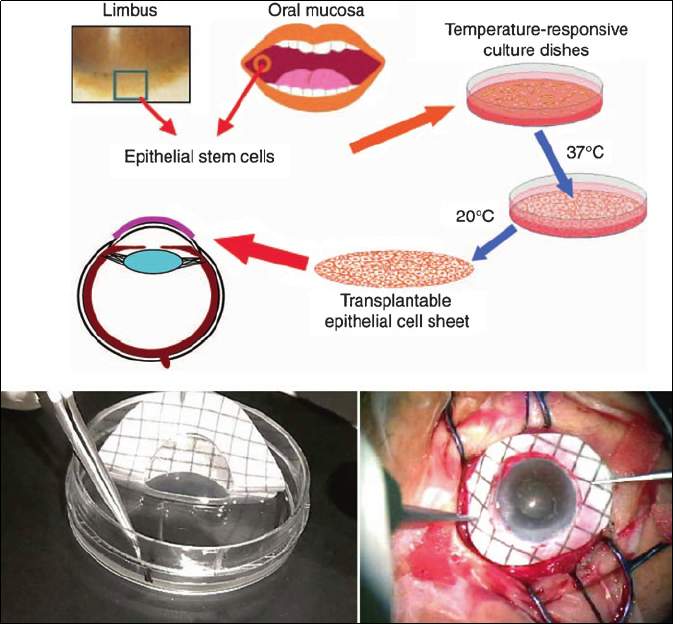
图1 角膜表面重建
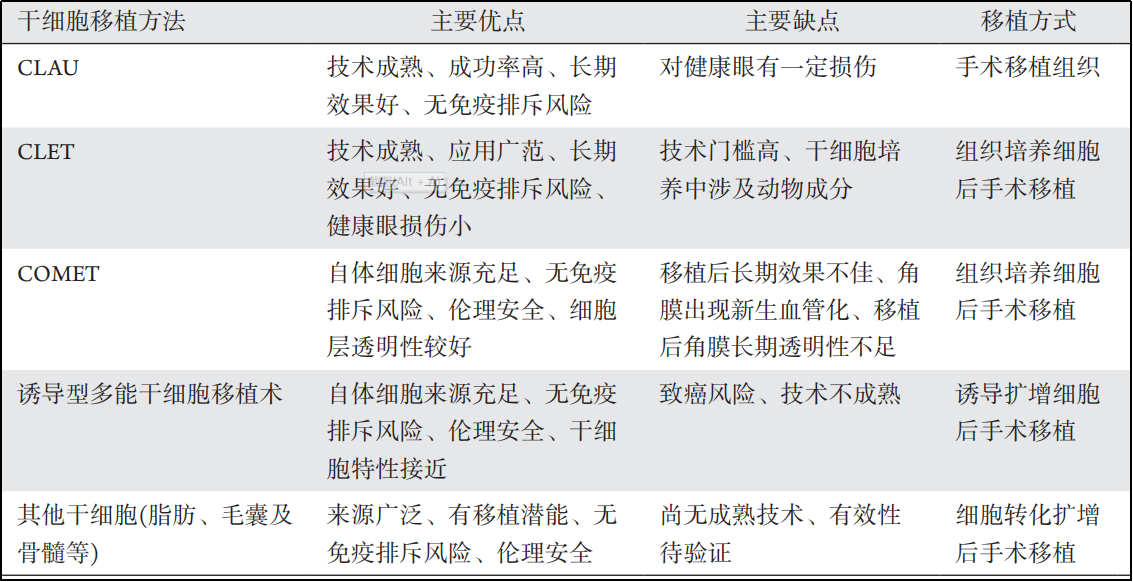
角膜缘干细胞缺乏症 (limbal stem cell deficiency,LSCD)指角膜缘干细胞的缺失或功能障碍,表现为角膜新生血管和结膜化,可通过对眼表细胞进行转移、印迹和免疫染色,即印迹细胞学(impression cytology)验证[4]。LSCD的临床症状包括慢性眼表不适、视力下降、畏光等,病因可分为2类:外在原因,如化学烧伤、放射线和感染等;内在原因,如Stevens-Johnson综合征(Stevens-Johnson syndrome,SJS)、无虹膜、单纯疱疹性角膜炎和慢性角膜缘炎等。对于角膜中心部分相对透明的部分LSCD,应选择保守措施进行治疗[5],而对于较严重或完全的LSCD病例,通过移植手术补充角膜缘干细胞则被考虑为主要的治疗方法。传统的LSCD移植治疗方法主要包括结膜角膜缘自体移植(conjunctival limbal autograft,CLAU)、角膜缘异体移植(limbal allograft,LAL)以及人工角膜移植。
表1 干细胞移植重建角膜上皮方法的优缺点
角膜基质约占角膜厚度的90%,主要由I型和V型胶原纤维片层状排列组成[6],为角膜提供了结构支撑和抗拉强度、稳定性和透明等重要特性。角膜基质细胞位于角膜缘片层之间产生胶原蛋白和蛋白多糖,从而有助于角膜基质的稳定、细胞外基质的调节以及愈合过程[7]。在角膜损伤修复过程中,角膜基质细胞容易变性转化为成纤维细胞和肌成纤维细胞,且此过程不可逆转,通常会造成角膜的混浊。
角膜基质干细胞存在于角膜缘基质中,能通过基底膜与角膜缘干细胞有直接的细胞连接,为角膜缘干细胞提供支持维持其干细胞特性[8]。角膜缘基质干细胞表达间充质和干细胞相关的表面标志物(CD73、CD90、CD105、CD140b),能够在体外分化为脂肪、骨和软骨。研究人员成功从角膜缘上层组织中分离出角膜基质干细胞,可形成表达干细胞基因(ABCG2、Nestin、NGFR、Oct4、PAX6和Sox2)的克隆球,并且能进一步分化为表达ALDH3A1、AQP1、KERA和PTGDS等标志基因的角膜基质细胞。当移植到小鼠角膜伤口中时,角膜基质干细胞可防止光散射瘢痕组织的形成。此外,角膜中注射分离的角膜基质干细胞,可以恢复角膜基质的透明度和结构,其外泌体也对受伤角膜起促进愈合的作用。除了角膜基质的原生干细胞外,来源于骨髓、脐带、脂肪组织、人羊膜的其他间质干细胞以及iPSCs治疗也能防止受伤角膜基质的不透明和新生血管。干细胞能通过类似的机制调节角膜基质愈合:向角膜基质细胞分化、抑制中性粒细胞的浸润和功能、免疫调节、防止异常细胞外基质(extracellular matrix,ECM)沉积、优选产生正常ECM成分、释放旁分泌因子影响周围损伤细胞和正常细胞来防止角膜瘢痕。尽管角膜基质干细胞的研究在近期获得了一些进展,但距离真正的角膜基质层重建还有一定距离,需要克服细胞纯度、细胞特征鉴定、细胞移植术式建立等一系列困难[9]。
角膜内皮细胞是神经嵴衍生的细胞,位于特殊的细胞外基质上,维持着角膜基质水合所必需的狭窄生理范围,同时通过离子转运功能抵消了从基质到房水的扩散梯度并进行物质转运,对角膜功能的实现至关重要。人角膜内皮细胞无法再生,受损后细胞通常会发生变形、变大,但整体数量相应减少,导致角膜内皮功能失代偿。当细胞密度低于维持其生理功能的临界密度,将发生严重的病理改变。体外获得角膜内皮干细胞的技术还不成熟,只有少数研究开发了获得具备角膜内皮前体细胞特征细胞的体外方法,应用细胞移植技术治疗角膜内皮疾病的报导较少。2018年,研究人员将体外扩增培养的异体内皮细胞注射到11例大疱性角膜病患者前房。24周的随访后接受治疗的眼睛的角膜内皮细胞密度均超过500个细胞/mm2,其中10个超过1000个细胞/mm2,且没有发生任何不良事件。该临床试验表明了细胞移植技术治疗角膜内皮疾病是可行的。牙髓干细胞也被证明可转化为表达ZO1、ATP1A1以及COL4A2等角膜内皮特异性标志物的细胞,有望作为角膜内皮细胞的替代细胞[10]。
近30年角膜领域新技术使数百万患者免于失明,但利用角膜缘干细胞重建功能性角膜仍需深入研究,如鉴定更多的特异性干细胞标志物,包括细胞表面标志物以检测和富集干细胞群体;研发维持角膜缘干细胞扩增的稳定体系,避免细胞在体外培养过程中增殖能力减弱;此外,应着力解决诸如大规模无异种蛋白(Xeno-free)培养、干细胞治疗GMP通用化以及低不良反应高效免疫抑制等瓶颈问题。角膜基质和角膜内皮的干细胞治疗相比角膜上皮仍处于不成熟阶段。角膜基质干细胞缺乏国际范围内认可的特异性标志物,临床试验尚未开展。角膜内皮细胞则需要寻找种子细胞以实现“开源”,同时也需要发展成熟的干细胞治疗方
案来实现科研和临床的同步。
参考文献
[1] World report on vision[R]. Geneva: World Health Organization; 2019.
[2] Fuest M, Yam GH, Peh GS, et al. Advances in corneal cell therapy[ J]. Regen Med, 2016, 11(6): 601-615.
[3] Dua HS, Forrester JV. The corneoscleral limbus in human corneal epithelial wound healing[ J]. Am J Ophthalmol, 1990, 110(6): 646-656.
[4] Le Q, Xu J, Deng SX. The diagnosis of limbal stem cell deficiency[ J]. Ocul Surf, 2018, 16(1): 58-69.
[5] Dua HS. The conjunctiva in corneal epithelial wound healing[ J]. Br J Ophthalmol, 1998, 82(12): 1407-1411.
[6] Ruberti JW, Sinha Roy A, Roberts CJ. Corneal biomechanics and biomaterials[ J]. Annu Rev Biomed Eng, 2011, 13: 269-295.
[7] Chen S, Mienaltowski MJ, Birk DE. Regulation of corneal stroma extracellular matrix assembly[ J]. Exp Eye Res, 2015, 133: 69-80.
[8] Meyer-Blazejewska EA, Call MK, Yamanaka O, et al. From hair to cornea: toward the therapeutic use of hair follicle-derived stem cells in the treatment of limbal stem cell deficiency[J]. Stem Cells, 2011, 29(1): 57-66.
[9] Yokoo S, Yamagami S, Yanagi Y, et al. Human corneal endothelial cell precursors isolated by sphere-forming assay[ J]. Invest Ophthalmol Vis Sci, 2005, 46(5): 1626-1631.
[10] Bosch BM, Salero E, Núñez-Toldrà R, et al. Discovering the potential of dental pulp stem cells for corneal endothelial cell production: a proof of concept[ J]. Front Bioeng Biotechnol, 2021, 9: 617724.
成都市武侯区一环路南一段24号四川大学科技创新中心405号
yhsw33399@163.com
028-85217799
